
- 1
- 2
- 3
- 4
- 5
- 6
- 31
在 2025 年第 56 届美国妇科肿瘤学年会(SGO 2025)上,国家癌症中心、中国医学科学院肿瘤医院佐晶教授团队公布了 Enlonstobart(SG001)联合铂类化疗 ± 贝伐珠单抗用于 PD-L1 阳性复发/转移性宫颈癌一线治疗的安全性导入期研究结果。研究纳入 31 例患者,评估 SG001 的安全性及初步疗效。数据显示,该联合方案总体安全性可控,未有患者因治疗相关不良事件停药或死亡,同时展现出较高的客观缓解率(80.6%)和显著的无进展生存期(15.1 个月),为后续 III 期随机研究奠定了基础。
研究背景
近年来,中国宫颈癌发病率持续上升,2022 年新增病例约 150,700 例,死亡 55,700 例。对于复发/转移性宫颈癌,现行一线标准治疗仍以铂类化疗 ± 贝伐珠单抗为主。然而,随着免疫治疗的发展,PD-1 单克隆抗体在该领域展现出良好的治疗前景。Enlonstobart(SG001)是一种全人源化、高亲和力抗 PD-1 IgG4 单克隆抗体,已获批用于 PD-L1 阳性复发/转移性宫颈癌的二线及以上治疗。本研究旨在探索 SG001 联合标准治疗方案在一线治疗中的安全性及初步疗效。
研究方法
本研究为多中心、随机、双盲 III 期临床试验(NCT05715840),旨在评估 SG001 联合铂类化疗 ± 贝伐珠单抗相较于安慰剂联合化疗 ± 贝伐珠单抗的疗效及安全性。此次公布的安全性导入期数据纳入了 31 例患者,主要终点为安全性评估,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)等。
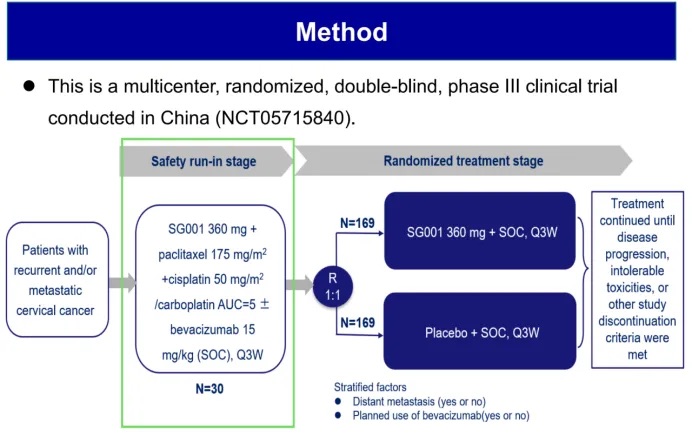
研究结果
截至 2024 年 8 月 30 日,中位随访时间为 11.8 个月,共 16 例患者接受 SG001 联合治疗。
安全性
31 例患者均发生治疗相关不良事件(TEAEs),其中 67.7%(21 例)出现 3 级及以上 TEAEs。最常见的 3 级及以上不良事件包括白细胞减少、中性粒细胞减少、恶心、脱发和贫血。
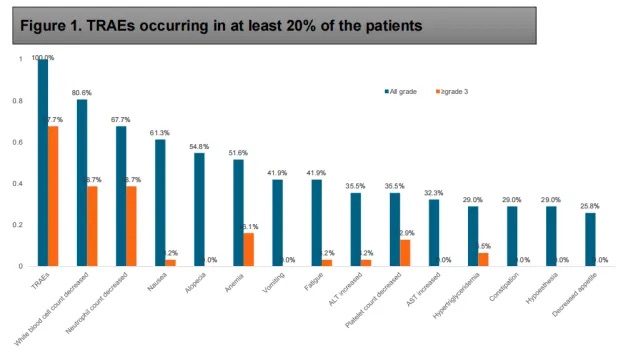
至少20%患者发生的TRAEs
疗效评估
客观缓解率(ORR):80.6%(95%CI 62.5%-92.6%),其中 5 例患者完全缓解,20 例部分缓解。
疾病控制率(DCR):90.3%(95%CI 74.3%-98.0%)。
缓解持续时间(DoR):中位 DoR 未达到,12 个月 DoR 率为 51.6%。
无进展生存期(PFS):中位 PFS 为 15.1 个月(95%CI 9.9-NR)。
反应时间(TTR):中位 TTR 仅 1.38 个月,显示出快速起效的特点。
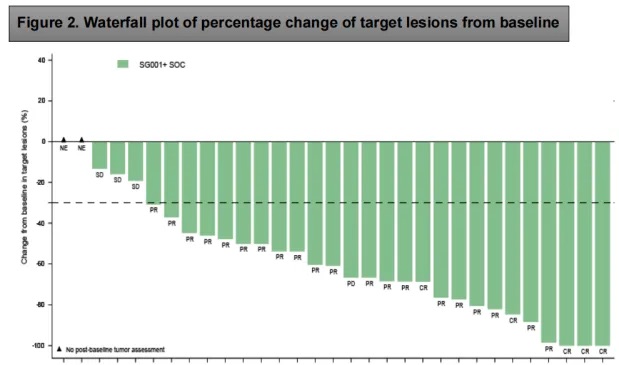
靶病灶自基线起变化百分比瀑布图
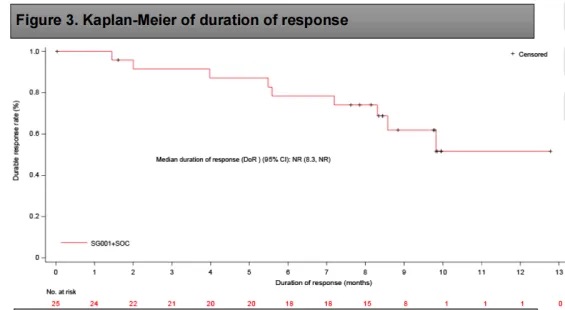
DOR的Kaplan-Meier曲线
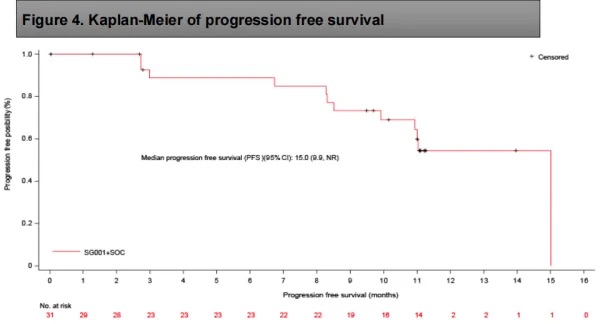
PFS的Kaplan-Meier曲线
研究结论
SG001 联合标准治疗方案在 PD-L1 阳性复发/转移性宫颈癌一线治疗中展现出良好的安全性和可控的不良反应,未出现因治疗相关不良事件导致的停药或死亡。此外,该方案在疗效方面表现突出,ORR 高达 80.6%,PFS 明显延长,缓解持续时间较长,提示其具有潜在的临床价值。当前数据支持研究进入 III 期随机阶段,患者招募工作正在积极推进。
公众号“学术时间”、“原点医生”及网站“学术时间”内容仅供医学专业人士参考。来源注明为“学术时间”或“原点医生”的内容版权均属坐标原点公司所有,授权转载时请注明来源。注明来源为其他媒体的内容版权归原作者所有,如有侵权请及时联系。